- מהי תגובה כימית?
- שינויים פיזיקליים וכימיים בחומר
- מאפיינים של תגובה כימית
- כיצד מיוצגת תגובה כימית?
- סוגים ודוגמאות של תגובות כימיות
- חשיבותן של תגובות כימיות
- מהירות תגובה כימית
אנו מסבירים מהי תגובה כימית, הסוגים הקיימים, מהירותם ומאפיינים נוספים. כמו כן, שינויים פיזיקליים וכימיים.
מהי תגובה כימית?
תגובות כימיות (נקראות גם שינויים כימיים אוֹ תופעות כימיות) הם תהליכים תרמודינמיים של טרנספורמציה של חוֹמֶר. שניים או יותר מעורבים בתגובות אלו חומרים (ריאגנטים או מגיבים), המשתנים באופן משמעותי בתהליך, ויכולים לצרוך או לשחרר אֵנֶרְגִיָה ליצור שני חומרים או יותר הנקראים מוצרים.
כל תגובה כימית מעבירה חומר לטרנספורמציה כימית, ומשנה את המבנה וההרכב המולקולרי שלו (בניגוד ל שינויים פיזיים שמשפיעים רק על צורתו או מצב צבירה). שינויים כימיים מייצרים בדרך כלל חומרים חדשים, שונים ממה שהיה לנו בהתחלה.
תגובות כימיות יכולות להתרחש באופן ספונטני בטבע (ללא התערבות אנושית), או שהן יכולות להיווצר גם על ידי בני אדם במעבדה בתנאים מבוקרים.
רבים מהחומרים שאנו משתמשים בהם על בסיס יומי מתקבלים באופן תעשייתי מחומרים פשוטים יותר המשולבים באמצעות תגובה כימית אחת או יותר.
שינויים פיזיקליים וכימיים בחומר
שינויים פיזיקליים בחומר הם אלו שמשנים את צורתו מבלי לשנות את הרכבו, כלומר מבלי לשנות את סוג החומר המדובר.
שינויים אלה קשורים לשינויים במצב הצבירה של החומר (מוצק, נוזל, גזי) ותכונות פיזיקליות אחרות (צֶבַע, צְפִיפוּת, מַגנֶטִיוּת, וכו).
שינויים פיזיים הם בדרך כלל הפיכים מכיוון שהם משנים את צורתו או מצב החומר, אך לא את הרכבו. למשל, בעת רתיחה מים אנחנו יכולים להפוך נוזל לגז, אבל האדים שנוצרו עדיין מורכבים ממולקולות מים. אם נקפיא את המים, הם עוברים למצב מוצק אבל זה עדיין אותו חומר מבחינה כימית.
שינויים כימיים משנים את ההתפלגות והקשר של אטומים של החומר, משיגים שהם משולבים בצורה שונה, ובכך מקבלים חומרים שונים מהראשוניים, אם כי תמיד זהים פּרוֹפּוֹרצִיָהמכיוון שאי אפשר ליצור או להרוס חומר, רק להפוך אותו.
לדוגמה, אם נגיב מים (H2O) ואשלגן (K), נקבל שני חומרים חדשים: אשלגן הידרוקסיד (KOH) ומימן (H2). זוהי תגובה שבדרך כלל משחררת הרבה אנרגיה ולכן היא מסוכנת מאוד.
מאפיינים של תגובה כימית
תגובות כימיות הן בדרך כלל תהליכים בלתי הפיכים, כלומר, הם כוללים היווצרות או הרס של קישורים כימיים בין ה מולקולות של הריאגנטים, יוצר אובדן או רווח של אנרגיה.
בתגובה כימית, החומר עובר טרנספורמציה עמוקה, אם כי לפעמים לא ניתן לראות את ההרכבה מחדש בעין בלתי מזוינת. ובכל זאת, ניתן למדוד את הפרופורציות של המגיבים, אשר מטופלת באמצעות סטוכיומטריה.
מצד שני, תגובות כימיות יוצרות תוצרים מסוימים בהתאם לאופי המגיבים, אך גם בתנאים שבהם התגובה מתרחשת.
נושא חשוב נוסף בתגובות כימיות הוא המהירות שבה הן מתרחשות, שכן השליטה על מהירותן חיונית לשימוש בהן תַעֲשִׂיָה, תרופות וכו'. במובן זה, ישנן שיטות להגביר או להקטין את המהירות של תגובה כימית.
דוגמה לכך היא שימוש בזרזים, חומרים המגבירים את מהירות התגובות הכימיות. חומרים אלו אינם לוקחים חלק בתגובות, הם רק שולטים בקצב התרחשותם. ישנם גם חומרים הנקראים מעכבים, שמשתמשים בהם באותו אופן אך גורמים להשפעה הפוכה, כלומר מאטים תגובות.
כיצד מיוצגת תגובה כימית?
תגובות כימיות מיוצגות על ידי משוואות כימיות, כלומר, נוסחאות שבהם מתוארים הריאגנטים המשתתפים והמוצרים שהושגו, ולעיתים מצביעים על תנאים מסוימים הטבועים בתגובה, כגון נוכחות של חום, זרזים, אור וכו'.
המשוואה הכימית הראשונה בהיסטוריה נוסחה בשנת 1615 על ידי ז'אן בגין, באחת המסתות הראשונות על כִּימִיָה, ה טירוציניום כימיקום. כיום הם בעלי הוראה משותפת ובזכותם אנו יכולים לדמיין ביתר קלות את המתרחש בתגובה מסוימת.
הדרך הכללית לייצג משוואה כימית היא:
איפה:
- A ו-B הם המגיבים.
- C ו-D הם המוצרים.
- ל, ב, ג י ד הם המקדמים הסטוכיומטריים (הם מספרים שמציינים את כמות המגיבים והתוצרים) שיש להתאים כך שתהיה אותה כמות של כל יסוד במגיבים ובתוצרים. בדרך זו מתקיים חוק שימור המיסה (הקובע כי מסה הוא לא נוצר ולא נהרס, הוא רק הופך).
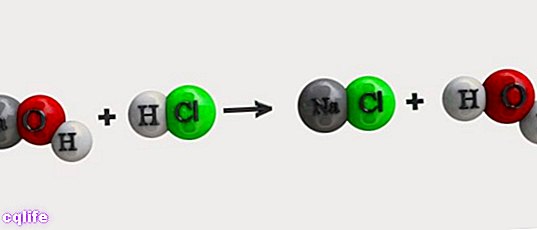
סוגים ודוגמאות של תגובות כימיות
ניתן לסווג תגובות כימיות לפי סוג המגיבים המגיבים. בהתבסס על זה, ניתן להבחין בין תגובות כימיות אנאורגניות לבין תגובות כימיות אורגניות. אבל ראשית, חשוב להכיר כמה מהסמלים המשמשים לייצוג התגובות הללו באמצעות משוואות כימיות:
תגובות אנאורגניות. כרוך תרכובות אנאורגניות, וניתן לסווג אותם כדלקמן:
- לפי סוג הטרנספורמציה.
- תגובות סינתזה או הוספה. שני חומרים מתחברים כדי ליצור חומר שונה. לדוגמה:
- תגובות פירוק. חומר מתפרק למרכיביו הפשוטים, או שחומר אחד מגיב עם אחר ומתפרק לחומרים אחרים המכילים את מרכיביו. לדוגמה:
- תגובות עקירה או החלפה. תרכובת או יסוד תופסים את מקומו של אחר בתרכובת, מחליפים אותו ומשאירים אותו חופשי. לדוגמה:
- תגובות החלפה כפולות. שני מגיבים מחליפים תרכובות או יסודות כימיים בּוֹ זְמַנִית. לדוגמה:
- תגובות סינתזה או הוספה. שני חומרים מתחברים כדי ליצור חומר שונה. לדוגמה:
- לפי סוג וצורת האנרגיה המוחלפת.
- תגובות אנדותרמיות. חום נספג כך שהתגובה יכולה להתרחש. לדוגמה:
- תגובות אקסותרמיות. חום מופק כאשר התגובה מתרחשת. לדוגמה:
- תגובות אנדולומיניות. נָחוּץ אוֹר כדי שהתגובה תתרחש. לדוגמה: פוטוסינתזה.
- תגובות חריגות. אור מופק כאשר התגובה מתרחשת. לדוגמה:
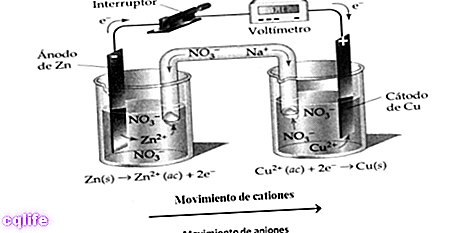
- תגובות אנדולקטריות. נָחוּץ כוח חשמלי כדי שהתגובה תתרחש. לדוגמה:
- תגובות אקזואלקטריות. אנרגיה חשמלית משתחררת או נוצרת כאשר התגובה מתרחשת. לדוגמה:
- תגובות אנדותרמיות. חום נספג כך שהתגובה יכולה להתרחש. לדוגמה:
- לפי מהירות התגובה.
- תגובות איטיות כמות הריאגנטים הנצרכת וכמות המוצרים הנוצרים בזמן נתון היא קטנה מאוד. למשל: חמצון של ברזל. זוהי תגובה איטית, שאנו רואים על בסיס יומיומי בחפצי ברזל חלודים. אם התגובה הזו לא הייתה איטית, לא היו לנו מבני ברזל ישנים מאוד בעולם של היום.
- תגובות מהירות. כמות הריאגנטים הנצרכת וכמות המוצרים הנוצרים בזמן נתון היא רבה. לדוגמא: התגובה של נתרן עם מים היא תגובה שבנוסף להתרחשות מהירה היא מסוכנת מאוד.
- תגובות איטיות כמות הריאגנטים הנצרכת וכמות המוצרים הנוצרים בזמן נתון היא קטנה מאוד. למשל: חמצון של ברזל. זוהי תגובה איטית, שאנו רואים על בסיס יומיומי בחפצי ברזל חלודים. אם התגובה הזו לא הייתה איטית, לא היו לנו מבני ברזל ישנים מאוד בעולם של היום.
- לפי סוג החלקיק המעורב.
- תגובות בסיס חומצה. מועברים פרוטונים (H+). לדוגמה:
- תגובות חמצון-הפחתה. מועברים אלקטרונים. בסוג זה של תגובה עלינו להסתכל על מספר החמצון של היסודות המעורבים. אם מספר החמצון של יסוד עולה, הוא מתחמצן, אם הוא יורד, הוא מצטמצם. לדוגמא: בתגובה זו ברזל מתחמצן וקובלט מופחת.
- תגובות בסיס חומצה. מועברים פרוטונים (H+). לדוגמה:
- לפי כיוון התגובה.
- תגובות הפיכות. הם הולכים לשני הכיוונים, כלומר, המוצרים יכולים להפוך שוב למגיבים. לדוגמה:
- תגובות בלתי הפיכות. הם מתרחשים רק במובן אחד, כלומר, המגיבים הופכים לתוצרים ותהליך הפוך לא יכול להתרחש. לדוגמה:
- תגובות הפיכות. הם הולכים לשני הכיוונים, כלומר, המוצרים יכולים להפוך שוב למגיבים. לדוגמה:
תגובות אורגניות. הם מערבים תרכובות אורגניות, שהן אלו הקשורות לבסיס החיים. הם תלויים בסוג התרכובת האורגנית לסיווגם, שכן לכל קבוצה פונקציונלית יש מגוון של תגובות ספציפיות. לדוגמה, אלקנים, אלקנים, אלקנים, אלכוהול, קטונים, אלדהידים, אתרים, אסטרים, ניטרילים וכו'.
כמה דוגמאות לתגובות של תרכובות אורגניות הן:
- הלוגן של אלקנים. מימן של האלקן מוחלף בהלוגן המתאים.
- בעירה של אלקנים. אלקנים מגיבים עם חמצן כדי לתת פחמן דו חמצני ומים. סוג זה של תגובה משחרר כמות גדולה של אנרגיה.
- הלוגנציה של אלקנים. שניים מהמימנים המצויים על הפחמנים היוצרים את הקשר הכפול מוחלפים.
- הידרוגנציה של אלקנים. שני מימנים מתווספים לקשר הכפול, ובכך מייצרים את האלקן המתאים. תגובה זו מתרחשת בנוכחות זרזים כגון פלטינה, פלדיום או ניקל.
חשיבותן של תגובות כימיות
הן הפוטוסינתזה והן הנשימה הן דוגמאות לתגובות כימיות.תגובות כימיות מהוות יסוד לקיומו ולהבנתו של העולם כפי שאנו מכירים אותו. השינויים שעובר החומר בתנאים טבעיים או מעשה ידי אדם (ושלרוב מייצרים חומרים יקרי ערך) הם רק דוגמה אחת. העדות הגדולה ביותר לחשיבותן של תגובות כימיות היא החיים עצמם, על כל ביטוייהם.
קיומו של יצורים חיים מכל הסוגים אפשרי רק הודות ליכולת התגובה של החומר, שאפשרה לצורות החיים התאיות הראשונות להחליף אנרגיה עם סביבתן בדרכים מטבוליות, כלומר באמצעות רצפים של תגובות כימיות שהניבו יותר אנרגיה שימושית מאשר נצרך.
לדוגמה, בחיי היומיום שלנו נְשִׁימָה הוא מורכב מתגובות כימיות מרובות, אשר קיימות גם ב פוטוסינתזה של ה צמחים.
מהירות תגובה כימית
תגובות כימיות דורשות זמן מוגדר להתרחשות, אשר משתנה בהתאם לאופי המגיבים והסביבה בה מתרחשת התגובה.
גורמים המשפיעים על קצב התגובות הכימיות הם בדרך כלל:
- עליה בטמפרטורות טמפרטורות גבוהות נוטות להגביר את מהירות התגובות הכימיות.
- לחץ מוגבר. הגדלת הלחץ בדרך כלל מגבירה את מהירות התגובות הכימיות. זה מתרחש בדרך כלל כאשר חומרים רגישים לשינויי לחץ, כגון גזים, מגיבים. במקרה של נוזלים ומוצקים, שינויים בלחץ אינם גורמים לשינויים משמעותיים בקצב התגובות שלהם.
- מצב צבירה שבו נמצאים הריאגנטים. מוצקים נוטים להגיב לאט יותר מנוזלים או גזים, אם כי המהירות תהיה תלויה גם בתגובתיות של כל חומר.
- שימוש בזרזים (חומרים המשמשים להגברת מהירות התגובות הכימיות). חומרים אלו אינם לוקחים חלק בתגובות, הם רק שולטים בקצב התרחשותם. ישנם גם חומרים הנקראים מעכבים, שמשתמשים בהם באותו אופן אך גורמים להשפעה הפוכה, כלומר מאטים תגובות.
- אנרגיה זוהרת (אור). חלק מהתגובות הכימיות מואצות כאשר מאיר עליהן אור.
- ריכוז ריאגנטים. רוב התגובות הכימיות מתרחשות מהר יותר אם יש להן ריכוז גבוה של הריאגנטים שלהן.

